Nerandomilast bromsar lungfunktionsförsämring vid IPF och PPF – likvärdig tolerans som placebo
Nerandomilast uppnådde det primära effektmåttet i båda fas 3-studierna, FIBRONEER™-IPF och FIBRONEER™-ILD, där svenska patienter deltagit, genom att signifikant minska försämringen av forcerad vitalkapacitet (FVC) [mL] i absolut förändring från baslinjen vid vecka 52, jämfört med placebo. (1, 2) Nerandomilasts säkerhets- och tolerabilitetsprofil var konsekvent i båda studierna, med en liknande andel permanenta behandlingsavbrott som för placebo. (1, 2) Nerandomilastdoserna i de båda studierna visade inte någon statistiskt signifikant effekt på det sammansatta sekundära effektmåttet (tid till första akuta exacerbation, första sjukhusinläggning på grund av respiratorisk orsak eller dödsfall). I FIBRONEER™-ILD-studien inträffade dödsfall i numerärt färre fall bland patienter som behandlades med nerandomilast jämfört med placebo. (1, 2) Ansökningar om godkännande för nerandomilast vid idiopatisk lungfibros (IPF) och progressiv lungfibros (PPF) har lämnats in i USA, Kina och EU – och fler regioner kommer därefter.
De fullständiga resultaten från fas 3-studierna FIBRONEER™-IPF och FIBRONEER™-ILD, som utvärderat nerandomilast – en oral fosfodiesteras 4B-hämmare (PDE4B) – hos patienter med idiopatisk lungfibros (IPF) respektive progressiv lungfibros (PPF) med och utan samtidig antifibrotisk behandling, publicerades nyligen i New England Journal of Medicince och presenterades samtidigt vid den internationella ATS-kongressen (American Thoracic Society) i San Fransisco, USA.
Nerandomilast är en substans och har ännu inte godkänts för användning.
Båda studierna uppnådde det primära effektmåttet för båda doserna, 9 mg och 18 mg, mätt som en minskning i absolut förändring från baslinjen i forcerad vitalkapacitet (FVC) [mL] vid vecka 52 jämfört med placebo. (1, 2) FVC är ett mått på lungfunktion. (3)
– Efter flera utmaningar inom forskarvärlden att ta fram nya kliniska data fortsätter IPF och PPF att ha en stark inverkan på patienterna, säger Toby Maher, professor i klinisk medicin vid Keck School of Medicine, USC Los Angeles. Att två fas 3-studier uppnår det primära effektmåttet är ett genombrott för det vetenskapliga samfundet och det har potential för en meningsfull inverkan på patienters ouppfyllda behov, både som monoterapi och i kombination med befintliga behandlingar.
I båda studierna observerades liknande frekvenser av permanenta behandlingsavbrott jämfört med placebo: I FIBRONEER™-IPF ledde biverkningar till permanent avbrytande av studiedosen hos 14 % i nerandomilast 18 mg-gruppen, 11,7 % i nerandomilast 9 mg-gruppen och 10,7 % i placebogruppen. (1, 2) I FIBRONEER™-ILD ledde biverkningar till permanent behandlingsavbrott hos 10,0 % i nerandomilast 18 mg-gruppen, 8,1 % i nerandomilast 9 mg-gruppen och 10,2 % i placebogruppen. (2) Det sågs inga obalanser mellan nerandomilast- och placebogrupperna i de båda studierna vad gäller biverkningar av särskilt intresse, såsom vaskulit, depression, suicidalt beteende eller läkemedelsinducerad leverskada. (1, 2)
– Behandlingen tolererades väl av de flesta patienter, och vi såg en stabilisering av lungfunktionen för dem under studiens gång. För många fungerade den också utan komplikationer i kombination med deras tidigare antifibrotiska behandling, säger Emil Ekbom, specialistläkare och doktorand vid Akademiska sjukhuset i Uppsala – och en av de svenska prövarna i studien.
Fakta om det kliniska prövningsprogrammet FIBRONEER
FIBRONEER™-IPF: Studiens upplägg och resultat (1)
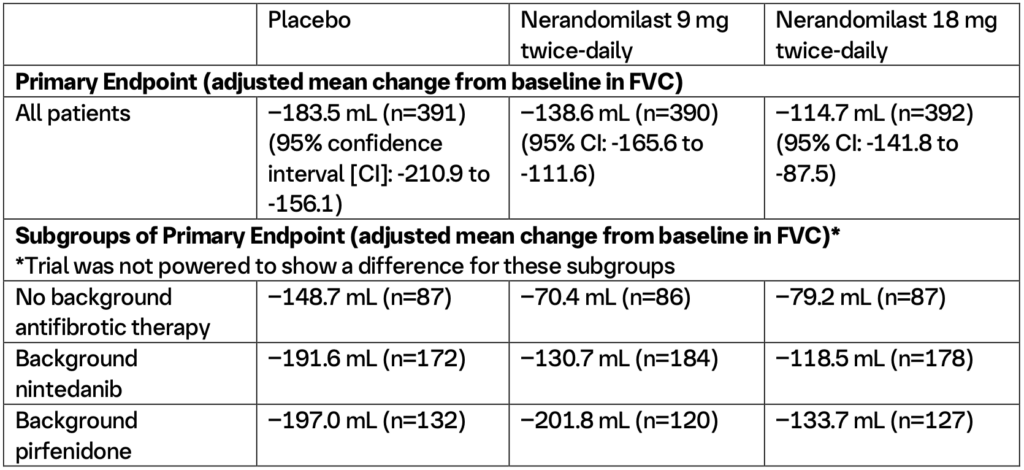
FIBRONEER™-IPF (NCT05321069) var en dubbelblind, randomiserad, placebokontrollerad studie som utvärderade effekt och säkerhet för nerandomilast under minst 52 veckor hos patienter med idiopatisk lungfibros (IPF). Totalt randomiserades 1 177 patienter i 36 länder, däribland fem från Sverige, i förhållandet 1:1:1 till att få nerandomilast 9 mg två gånger dagligen (n=392), nerandomilast 18 mg två gånger dagligen (n=392) eller placebo två gånger dagligen (n=393). Randomiseringen stratifierades utifrån samtidig antifibrotisk behandling, där 77,7 % av patienterna stod på nintedanib eller pirfenidon vid studiestart.
Viktiga effektresultat vid vecka 52, publicerade i New England Journal of Medicine, inkluderar:
Det sammansatta sekundära effektmåttet (tid till första akuta exacerbation, första sjukhusinläggning på grund av respiratorisk orsak eller död) uppnåddes inte.
Den vanligaste rapporterade biverkningen var diarré, som förekom hos 16,0 % i placebogruppen, 31,1 % i gruppen som fick nerandomilast 9 mg, och 41,3 % i gruppen som fick 18 mg. Den biverkning som oftast ledde till att studiedosen avbröts var också diarré, vilket inträffade hos 1,8 % i 9 mg-gruppen, 6,1 % i 18 mg-gruppen och 0,5 % i placebogruppen.
Övriga biverkningar var jämnt fördelade mellan behandlingsgrupperna, utan några obalanser mellan nerandomilast- och placebogrupperna vad gäller biverkningar av särskilt intresse, såsom vaskulit, depression, suicidalt beteende eller läkemedelsinducerad leverskada.
Biverkningar ledde oftare till behandlingsavbrott bland patienter som samtidigt behandlades med antifibrotisk bakgrundsbehandling, oavsett behandlingsgrupp. Allvarliga biverkningar rapporterades hos 33 % av patienterna i placebogruppen, 31 % i nerandomilast 9 mg-gruppen och 30 % i 18 mg-gruppen. Biverkningar med dödlig utgång inträffade hos 5 % av patienterna i placebogruppen, 4 % i 9 mg-gruppen och 2 % i 18 mg-gruppen.
FIBRONEER™-ILD: Studiens upplägg och resultat (2)
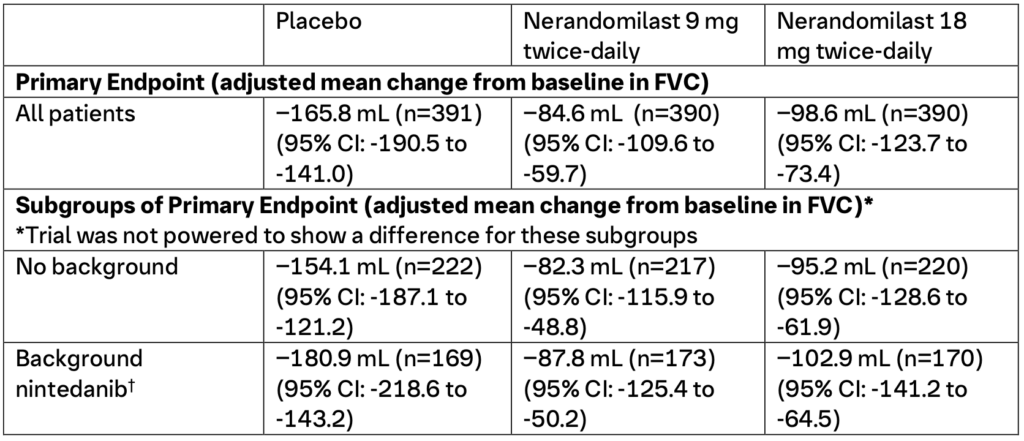
FIBRONEER™-ILD (NCT05321082) var en dubbelblind, randomiserad, placebokontrollerad studie som utvärderade effekt och säkerhet för nerandomilast under minst 52 veckor hos patienter med progressiv lungfibros (PPF). Totalt randomiserades 1 176 patienter i 44 länder, däribland två från Sverige, i förhållandet 1:1:1 till att få nerandomilast 9 mg två gånger dagligen (n=393), nerandomilast 18 mg två gånger dagligen (n=391) eller placebo två gånger dagligen (n=392). Randomiseringen stratifierades utifrån användning av bakgrundsbehandling med antifibrotisk terapi, där 43,5 % av deltagarna fick nintedanib. De viktigaste effektresultaten vid 52 veckor, publicerade i New England Journal of Medicine, inkluderar:
†2 patienter i denna grupp behandlades med pirfenidon istället för nintedanib. Dessa klassificerades som protokollavvikelser, men data från dessa patienter analyserades som en del av gruppen med bakgrundsbehandling med nintedanib.
Nerandomilast uppnådde inte statistisk signifikans för det sammansatta sekundära effektmåttet (tid till första akuta exacerbation, sjukhusinläggning på grund av respiratorisk orsak eller död), men det noterades numeriskt färre dödsfall i båda behandlingsgrupperna: 9 mg-gruppen (n=33/8,4 %), 18 mg-gruppen (n=24/6,1 %), jämfört med placebo (n=50/12,8 %).
Säkerhets- och tolerabilitetsprofilen för nerandomilast var i stort sett i linje med resultaten från FIBRONEER™-IPF. Den vanligaste rapporterade biverkningen var diarré, som förekom hos 24,7 % i placebogruppen, 29,5 % i gruppen som fick nerandomilast 9 mg två gånger dagligen, och 36,6 % i gruppen som fick 18 mg två gånger dagligen under en 52-veckorsperiod. Det fanns inga obalanser mellan nerandomilast- och placebogrupperna vad gäller biverkningar av särskilt intresse, såsom vaskulit, depression eller suicidalt beteende. De biverkningar som oftast ledde till behandlingsavbrott var ”förvärrat tillstånd” (dvs. försämring av lungfibros), vilket ledde till behandlingsavbrott hos 1,5 % i 9 mg-gruppen, 1,0 % i 18 mg-gruppen och 3,1 % i placebogruppen, samt diarré, som ledde till behandlingsavbrott hos 1,3 %, 2,6 % respektive 0,5 % i dessa behandlingsgrupper. Förekomsten av biverkningar som ledde till behandlingsavbrott var generellt likartad mellan patienter som behandlades med bakgrundsbehandling med nintedanib och de som inte gjorde det. Allvarliga biverkningar rapporterades hos 35,2 % av patienterna i placebogruppen, 31,8 % i nerandomilast 9 mg-gruppen och 33,2 % i 18 mg-gruppen. Biverkningar med dödlig utgång inträffade hos 5,1 % av patienterna i placebogruppen, 3,6 % i 9 mg-gruppen och 2,0 % i 18 mg-gruppen.